2. ANALYSEN
Schon Kast [7] hat 1909 Anleitungen zur chemischen und physikalischen Untersuchung von Spreng- und Zündstoffen gegeben. Auch Brunswig [8] gibt 1916 eine Einführung in die Chemie der explosiven Vorgänge.
Auch ich werde mich nun mit den Untersuchungen von explosiven Gegenständen, nämlich mit jugendfreiem Feuerwerk, befassen.
Die Durchführung der Analysen war lang und teilweise kompliziert. Ich habe mehr als 50 Stunden in die Analysen von 7 verschiedenen Feuerwerkskörpern investiert, die die gesamte Produktpalette von „jugendfreiem Feuerwerk“ im großen und ganzen vertreten soll. Leider sind die Ergebnisse, die bei manchen Untersuchen herausgekommen sind, nicht zufriedenstellend für mich verlaufen. Ich hätte gerne etwas mehr über die einzelnen pyrotechnischen Sätze erfahren. Aber dies war im Prinzip schon von vorne herein abzusehen. Die Mischungen gehören zu den Betriebsgeheimnissen der pyrotechnischen Firmen und konnten mir, auch nach konkreter Nachfrage, nicht genannt werden. Lediglich die Inhaltsstoffe der Wunderkerze und Knallteufel wurden mir mitgeteilt, weil dies ja auch kein großes Geheimnis mehr ist.
Sämtliche Analysen wurden nach den Prinzipien eines „Trennungsganges“ durchgeführt, der jedoch aufgrund der Zeit und vor allem der dazu benötigten Chemikalien nur zu einem Bruchteil angewendet werden konnte. So konnten quantitativ nur zwei Feuerwerkskörper untersucht werden. Dies hat aber trotzdem, wie schon erwähnt, eine lange Zeitspanne in Anspruch genommen. Die Arbeiten mußten aufgrund der Vorschriften im Sprengstoffgesetz (§ 40 Abs. 1 Nr. 1) in einem Universitätlabor durchgeführt werden.
Eine spektrometrische Analyse wurde nicht durchgeführt, weil dazu viel zu viele verschiedene Substanzen in den Gemischen sind, die die Peaks überlagern.
Nitratnachweis:
Der Nitratnachweis erfolgt mit dem „Aquamerck-Kompaktlabor für Wasseruntersuchungen“ von der Firma Merck. Das Prinzip beruht auf der Reduktion zu NO2- und anschließender Diazotierung und Kupplung zu einem rotvioletten Azofarbstoff. Es wird also kolorimetrisch nachgewiesen. Dieser Nachweis ist auch als Lunges Reagenz bekannt:

Zunächst wird eine qualitative Analyse mit 6%iger Kaliumnitratlösung durchgeführt:
Versuchsbeschreibung:
Es werden 0,06 g (60 mg) KNO3 in 1 l destilliertes Wasser gegeben und anschließend gut durchgerührt. Danach werden 5 ml abpipettiert und in ein extra dafür vorgesehenes Gläschen gegeben. In ein anderes kommen ebenfalls 5 ml der Kaliumnitratlösung. Nun wird das innere Glas mit 1 Mikrolöffel Reagenz 1 und danach mit 2 Mikrolöffel Reagenz 2 versetzt. Anschließend wird 1 Minute geschüttelt und noch weitere 5 Minuten gewartet, bis die Reaktion abgeschlossen ist. Jetzt kann man anhand der Farbskala den Wert ablesen.
Versuchsergebnis:
Es stellt sich tatsächlich ein Wert um die 60 mg/l ein.
Um die Nitrattests zu vereinfachen, wird ein weiterer Eichversuch durchgeführt, der jedoch nicht mit 1 l entmineralisiertem Wasser durchgeführt wird, sondern mit 100 ml. Zu diesem Zweck wird eine genauere Waage zur Hilfe genommen und eine bestimmte Menge des Kaliumnitrats abgewogen. Um in dem Bereich der Meßskala zu bleiben, soll die Nitratkonzentration bei 100 mg/l liegen. Dazu sind also 10 mg Kaliumnitrat in 100 ml Wasser zu lösen.
Versuchsdurchführung:
Man gibt vorsichtig mit einem Spatel ein paar Körner von Kaliumnitrat auf die Waage. Die Waage zeigt 0,00999 g an. Diese Menge wird in einen Erlenmeyerkolben gegeben und mit 100 ml Wasser aufgefüllt. Nun wird der Nitrattest nach Anleitung von Merck durchgeführt.
Versuchsergebnis:
Eine Durchführung des Nitrattests nach Anleitung bestätigt den Wert von einem Nitratgehalt von 100 mg/l.
Gesamtergebnis:
Beide Nitrattests sind ordnungsgemäß verlaufen und können zur weiteren Untersuchung nach Nitrat benutzt werden. Aufgrund der zur Verfügung stehenden Sartorius-Präzisionswaage wird bei sämtlichen Nitrattests die Variante mit den 100 ml Wasser angewendet.
2.1. Analyse von „Polar-Wunderkerze“
2.1.1. Allgemeines:
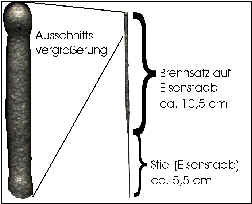
Es werden „Polar-Wunderkerzen“ der Firma „Weco“ untersucht, Artikelnummer 6151, BAM[1]-Zulassungsnummer „BAM-PI-0225“. Diese Sorte von Wunderkerze ist in 10er-Päckchen zu kaufen. Das Gesamtgewicht einer Wunderkerze beträgt im Schnitt etwa 1,740 g und enthält davon 0,815 g als Brennmasse. Der Eisenstab wiegt 0,635 g.
2.1.2. Aufbau:
![]()
2.1.3. Vorbereitungen:
Um eine Wunderkerze überhaupt erst analysieren zu können, muß sie in pulverisierter Form vorliegen. Dazu wird eine Wunderkerze genommen und mit Mörser und Pastill pulverisiert. Es entsteht nach mehreren Minuten ein feines Pulver.
2.1.4. Nitratnachweis:
Es wird versucht, eine Menge von ca. 10 mg Wunderkerzensatz abzuwiegen. Die Waage zeigt 0,01083 g an. Anschließend wird der Nitrattest durchgeführt. Die Farbskala zeigt einen Wert von ca. 60 mg/l an
2.1.5. Versuche:
2.1.5.1. Versuch 1
Versuch 1 findet in abgewogenen Reagenzgläsern statt:
2.1.5.1.1. Versuchsbeschreibung:
0,5 g Wunderkerzen-Pulver werden mit 3 ml Wasser versetzt, geschüttelt und zentrifugiert. Der Überstand wird vorsichtig abpipettiert und in ein neues Reagenzgefäß gegeben. Zu dem Überstand wird nun 1 ml 12 M Salzsäure hinzugefügt. Es entsteht eine gelbe Trübung. Nach Hinzugabe einer ausreichenden Menge (zur vollständigen Reaktion) 9 M Schwefelsäure entsteht ein weißer Niederschlag. Damit der Überstand in ein neues Reagenzglas abpipettiert werden kann, wird zunächst zentrifugiert. Das Reagenzgefäß mit dem weißen Niederschlag wird in einen Exsikkator (als Trockensubstanz wird P4O10 verwendet) gegeben, um es später abzuwiegen. Mit dem Überstand wird weiter experimentiert. Die stark saure Lösung wird nun mit 5 M NaOH-Lösung auf 10 ml aufgefüllt, so daß sie alkalisch wird. Zur Bestimmung des pH-Wertes wird Universallackmuspapier genommen. Es entsteht ein braun-roter Niederschlag. Nun wird wieder zentrifugiert und anschließend 4 ml von den 10 ml in ein neues Reagenzglas abpipettiert, zu dem weitere 6 ml Ammoniak hinzugegeben werden. Es erfolgt keine Reaktion. Der rot-braune Niederschlag wird in den Exsikkator gelegt, damit ihm die Feuchtigkeit entzogen wird, um ihn später zu wiegen.
2.1.5.1.2. Versuchsergebnis:
Die gelbe Trübung entsteht vermutlich durch eine winzige Menge von gelöstem Eisen(III)-chlorid das sich gebildet hat. Bariumdichlorid kann es auf jeden Fall nicht sein, weil dieses weiße Kristalle bildet und relativ leicht löslich ist. Es muß sich also irgend ein lösliches Eisensalz in dem Wunderkerzensatz befinden. Ein Fe3+-Salz ist dabei wahrscheinlicher als ein zweiwertiges Eisensalz, weil ansonsten eine zunächst blau-grüne Färbung (FeCl2) zu beobachten wäre und nach Hinzugabe der Schwefelsäure sich Eisensulfat gebildet hätte. Möglicherweise hat aber auch die sehr hohe Konzentration der Salzsäure die Bildung von blau-grünem Eisensulfat verhindert.
Der weiße Niederschlag ist aus Bariumnitrat und Schwefelsäure gebildetes schwerlösliches Bariumsulfat, welches gravimetrisch zur Errechnung der vorigen Bariumnitratkonzentration dienen kann.
Der rot-braune Niederschlag ist sehr wahrscheinlich gebildetes Eisen(III)-hydroxid. Das Hydroxid-Anion des Natriumhydroxids hat dem Eisen(III)-chlorid das Fe3+-Kation entzogen.
2.1.5.2. Versuch 2:
2.1.5.2.1. Versuchsbeschreibung:
Der Festsatz aus Versuch 1 wird mit 4 ml 5 M NaOH versetzt. Das Gemisch fängt an, ein wenig zu schäumen. Anschließend wird zentrifugiert. Danach wird der Überstand in ein neues Reagenzglas getan, zu dem nun ein paar Tropfen 1 M Calciumacetatlösung hinzugefügt werden. Es entsteht ein weißer Niederschlag. Eine Hinzugabe von einigen Tropfen 1 M Natriumthiocyanatlösung bringt keine Reaktion.
2.1.5.2.2. Versuchsergebnis:
Das Natriumhydroxid hat mit Aluminium zu einem Aluminiumhydroxidkomplex reagiert:
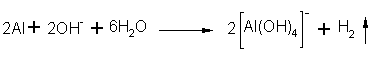
Der entstandene weiße Niederschlag ist Aluminiumhydroxidacetat und es riecht
ein wenig nach Essigsäure:
![]()
Da die Natriumthiocyanatlösung keine Färbung der Flüssigkeit bewirkt hat,
kann man davon ausgehen, daß sich höchstens Fe2+-Ionen in Lösung
befinden. Vermutlich ist bei Hinzugabe von NaOH weißes Fe(OH)2
enstanden. Leider konnte jedoch kein weiterer Test zur Prüfung auf Fe2+-Ionen
durchgeführt werden, weil dazu kein Kaliumhexcyanoferrat-(III) zur Verfügung
stand, welches eine „Turnbulls/Berliner“ blaue Färbung ergeben hätte.
2.1.5.3. Versuch 3:
2.1.5.3.1. Versuchsbeschreibung:
Man geht mit einem Magneten an das Wunderkerzengemisch heran. Magnetische Partikel bleiben am Magneten hängen.
2.1.5.3.2. Versuchsergebnis:
Die magnetischen Partikel sind Eisenspäne.
Errechnung des Bariumnitratgehaltes:
Das
leere Reagenzglas wog 6,6257 g. Mit dem Bariumsulfat wiegt es nun 6,84967 g. Das
bedeutet, das BaSO4 wiegt insgesamt 0,22397 g.
Die
Atommasse von Bariumnitrat ist 261,33 u, die von Schwefelsäure 98 u, die von
Bariumsulfat 233,33 u und die von Salpetersäure 63 u. Also kommt man mit Hilfe
des Dreisatzes nach untenstehender Rechnung auf ca. 0,251 g Bariumnitrat.
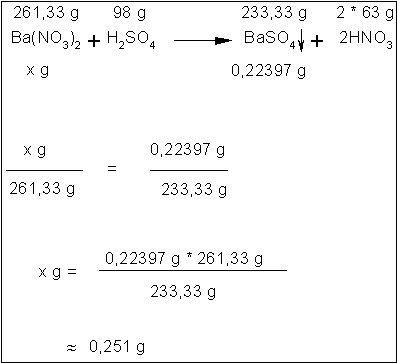
Errechnung des Eisenchlorid bzw. des Eisengehaltes:
Als leeres Reagenzglas wog dieses 6,5903 g. Mit dem Eisen(III)-hydroxid wiegt es jetzt 7,10363. Das Fe(OH)3 wiegt also 0,51333 g. Nach folgender Rechnung kommt man auf ca. 0,78 g Eisen(III)-chlorid. Der Fe3+-Ionengehalt, und im Prinzip ist dies das Gewicht von elementarem Eisen, beträgt demnach ca. 0,27 g.

Beurteilung der Versuchsergebnisse:
Der Inhalt eines Eisensalzes in der Wunderkerze ist sehr merkwürdig. Jedoch könnte das Eisenpulver in der Wunderkerze an der feuchten Luft ein wenig angerostet sein. Dagegen spricht jedoch die Farbe des Satzes. Es ist einheitlich grau. Unter dem Mikroskop betrachtet, kann man keine rostfarbenen Körner entdecken. Der hohe Anteil an Eisenionen ist außerdem unrealistisch. Mit ca. 0,27 g würde dieser ca. 50% des gesamten Wunderkerzensatzes ausmachen. Es muß sich also auf jeden Fall um einen Meßfehler handeln. Vermutlich ist das entstandene Eisen(III)-hydroxid nicht ganz wasserfrei gewesen, so daß ein zu hohes Gewicht gemessen wurde und es somit zu Folgefehlern in der Rechnung gekommen ist.
Eine Zusammensetzung aus ca. 50 % Bariumnitrat ist dagegen realistisch, obwohl der Nitrattest auf etwa 60% Nitratgehalt kommt. Eine gewisse Fehlerquote ist aber immer dabei.
2.1.6. Zusammenfassung der Versuchsergebnisse:
In Wunderkerzensätzen wird ca. 50-60% Bariumnitrat als Sauerstofflieferant eingesetzt. Als Brennmaterial wird Aluminium verwendet. Die wegsprühenden Funken sind glühende Eisenpartikel. Auf eine spätere Anfrage an die Firma „Weco“ wird mir mitgeteilt, daß Dextrin als Bindemittel verwendet wird.
2.2. Analyse von „Knallteufel“
2.2.1. Allgemeines:
Es werden „Knallteufel“ der Firma „Weco“ verwendet, Artikelnummer 1205, die in 50 Stück-Kartons in den Handel kommen. Die BAM-Zulassungsnummer lautet „BAM-PI-0698“. Das Gewicht eines „Knallteufels“ beträgt im Schnitt 0,258 g und wurde durch Abwiegen von 30 zufällig ausgewählten „Knallteufeln“ ermittelt.
2.2.2. Aufbau:
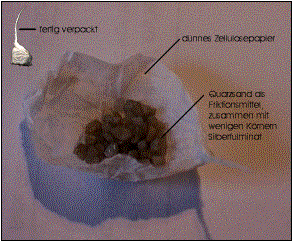
![]()
2.2.3. Vorbereitungen:
Um mit Knallteufeln experimentieren zu können, müssen diese zunächst „geschält“, d.h. die Papierhülle muß vorsichtig entfernt werden, damit sich die Inhaltsstoffe besser lösen können.
2.2.4. Nitratnachweis:
Ein Nachweis ist nicht erforderlich, weil nur Silberfulminat enthalten ist.
2.2.5.Versuche:
2.2.5.1. Versuch 1:
2.2.5.1.1. Versuchsbeschreibung:
Es werden 4 Stück (= 0,97 g) genommen, in 3 ml Wasser gegeben und kräftig geschüttelt. Danach wird die leicht milchig trüb gewordene Flüssigkeit von dem Quarzsand getrennt, indem sie filtriert wird. Anschließend werden 1,5 ml 12 M Salzsäure hinzugegeben. Mit bloßem Auge ist keine Reaktion festzustellen. Deswegen wird weiter 1 ml 9 M Schwefelsäure hinzugegeben. Keine Reaktion. Auch nach Hinzugabe von 6,5 ml NaOH auf 12 ml erfolgt keine Reaktion. Hinzugabe von einigen ml Ammoniak bewirkt auch keinerlei Reaktion.
2.2.5.1.2. Versuchsergebnis:
Die Trübung der Flüssigkeit kommt vermutlich von dem Quarzsand, der anscheinend nicht reingewaschen wurde. Da jede der Nachweismethoden fehlgeschlagen ist, gibt es nur noch vier verschiedende Möglichkeiten:
1. Es sind keine nachgewiesenen Stoffe enthalten.
2. Produkte, die durch Nachweisreaktionen entstanden sind, haben weiter reagiert.
3. Die Konzentration der Ausgangsstoffe war für sichtbare Reaktionen zu gering.
4. Es sind andere Substanzen enthalten, die nicht überprüft wurden.
Bewertung des Versuchsergebnisses:
Möglichkeit Nummer 1, 2 und 4 scheiden aus, weil ich später eine offizielle Mitteilung der Inhaltsstoffe von „Weco“ bekam, nachdem als Knallsatz „Silberfulminat“ verwendet wird, was auch meine Vermutung war. Quecksilberfulminat wäre wegen seiner erhöhten Gefährlichkeit nicht in Frage gekommen, wohl aber Phosphor und Chlorat Mischungen, die auch in Amorces Verwendung finden.
Da der Silbernachweis mit der Salzsäure anscheinend nicht funktioniert hat, wird ein weiterer Versuch mit höheren Konzentrationen durchgeführt:
2.2.5.2.Versuch 2:
2.2.5.2.1. Versuchsbeschreibung:
Es werden 30 Knallteufel (= 7,74 g), wie oben beschrieben, vorsichtig von der Papierhülle befreit, mit 5 ml Wasser versehen und geschüttelt. Durch Filtration wird der Quarzsand von der getrübten Flüssigkeit getrennt. Danach wird zentrifugiert und die nun klare Flüssigkeit vorsichtig abpipettiert und in ein neues Reagenzglas getan. Nach Aufsaugen durch das Filterpapier hat sich die Menge auf 1 ml reduziert. Zu dieser kommen nun weitere 1 ml 12 M Salzsäure. Nach dem ersten Tropfen fällt schlagartig ein leichter käsiger Niederschlag in der obersten Schicht der Flüssigkeit aus, der sich aber sofort nach weiterer Hinzugabe von Salzsäure wieder auflöst.
2.2.5.2. Versuchsergebnis:
Da Silberfulminat eine Ionenverbindung ist, lagert sich das Cl- der Salzsäure an das Silberkation des Fulminats an und bildet sofort einen käsigen Niederschlag aus schwerlöslichem Silberchlorid (pKL = 9,96).
![]()
Da jedoch ein Überschuß an Chlorid-Anionen (durch die starke Konzentration der Salzsäure) gegeben ist, reagiert das Silberchlorid zu einem leichter löslichen (pKL = 5,4) Silberchlorid-Komplex weiter.
![]()
Somit ist also keine quantitative Analyse auf diese Art und Weise möglich. Deswegen wird noch ein Zusatzversuch durchgeführt.
Zusatzversuch 1:
Zu Versuch 2 wird ein wenig Kaliumbromid hinzugegeben. Es tritt keine sichtbare Reaktion auf.
Versuchsergebnis:
Die gewünschte Fällung mit Kaliumbromid ist fehlgeschlagen. Da Silberbromid (pKL = 12,4) noch schwerer löslich als Silberchlorid gewesen wäre, hätte es ausfallen müssen. Anscheinend hat es aber mit dem Silberchlorid einen löslichen Komplex gebildet.
2.2.5.3. Versuch 3:
2.2.5.3.1. Versuchsbeschreibung:
Der Bodensatz aus wenigen Partikel von Versuch 2 wird mit Wasser vermischt und mit Kaliumbromidlösung versetzt. Es tritt kein Niederschlag auf.
2.2.5.3.2. Versuchsergebnis:
Die Substanz hat nichts mit dem Knallsatz zu tun und kommt vermutlich von Verunreinigungen des Quarzsandes, die hier nicht weiter untersucht werden sollen.
2.2.6. Zusammenfassung der Versuchsergebnisse:
Als Knallsatz wird in „Knallteufeln“ Silberfulminat verwendet, welches nur in sehr geringen Mengen vorkommt. Das Sprengstoffgesetz schreibt eine maximale Menge von 2,5 mg pro Knallsatz vor. Selbst unter einem Lichtmikroskop erkennt man nur vereinzelt wenige Kristalle. Deswegen ist es verständlich, daß Versuch 1 völlig daneben ging, weil die Konzentration zu gering war. Selbst mit der 30fachen Menge ist die Konzentration noch so gering, daß eine gravimetrische Bestimmung kaum durchzuführen ist.
2.3. Analyse von „Geisterlichter“ (grün)
2.3.1. Allgemeines:
Es werden „Geisterlichter“ der Firma „Weco“ verwendet, Artikelnummer 4418, die in 4er-Packungen in den Handel kommen. Darin sind jeweils zwei rote und zwei grüne Fontänen enthalten. Es werden jedoch nur die grünen analysiert. Die BAM-Zulassungsnummer lautet „BAM-PI-0537/0542“. Der Effektsatz dieses Feuerwerkskörpers wiegt 1,44 g.
2.3.2. Aufbau:
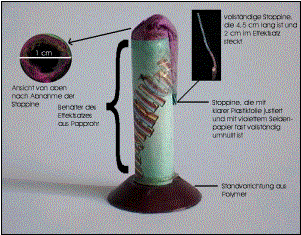
![]()
2.3.3.Vorbereitungen:
Um den Effektsatz zu analysieren, wird die Zündschnur mit samt dem violettfarbenen Seidenpapier entfernt, indem man zunächst das „Justierband“ zerschneidet, dann fest an der Stoppine zieht und diese entfernt. Jetzt ist der Effektsatz mit Hilfe eines Zahnstochers zur Lockerung frei zugänglich. Beim Entleeren des Papprohrs fällt auf, daß zunächst eine recht dunkle Mischung zu sehen ist, die jedoch recht schnell in eine einheitlich graue Mischung wechselt. Am Schluß kommt wieder eine etwas dunklere Schicht.
2.3.4. Nitratnachweis:
Es wird eine Menge von ca. 10 mg abgewogen. Die Waage zeigt einen Wert von 0,01003 g an. Nun wird der Nitrattest nach Merck durchgeführt. Nach Ablesen der Farbskala stellt sich ein Wert von ca. 40-60 mg/l heraus. Der Farbton tendiert aber eher zu den 40 mg/l.
2.3.5. Versuche:
2.3.5.1. Versuch 1:
2.3.5.1.1. Versuchsbeschreibung:
Ein Teil des Inhalts eines grünen „Geisterlichts“ (0,61 g) wird in 3,5 ml Wasser gelöst, geschüttelt, und anschließend zentrifugiert. Danach werden davon 2,5 ml abpipettiert und in ein neues Gefäß getan. Dieses wird mit 1,5 ml 12 M Salzsäure auf 4 ml aufgefüllt. Es entsteht eine gelbe Färbung. Nach Hinzugabe von 3 ml 9 M Schwefelsäure entsteht ein weißer Niederschlag. Nun wird zentrifugiert und von den 7 ml 4 ml in ein neues Reagenzgefäß getan. Die restlichen 3 ml in dem Reagenzglas mit dem weißen Niederschlag werden entfernt, damit die nun fast wasserfreie weiße Substanz in dem Exsikkator wasserfrei wird, um sie abzuwiegen.
Das neue Reagenzgefäß mit den 4 ml wird nun mit 7,5 ml 5 M NaOH alkalisch gemacht. Die vorher noch gelbe Flüssigkeit wird daraufhin klar, und am Boden setzt sich ein glasiger Niederschlag ab, der nun auch, nachdem von den 11,5 ml 4 ml in ein neues Reagenzglas getan und mit 6 ml Ammoniak gemischt worden sind, getrocknet wird. Bei der Hinzugabe von Ammoniak passiert nichts.
2.3.5.1.2. Versuchsergebnis:
Die
gelbe Färbung ist vermutlich ein winziger Anteil von gelöstem
Eisen(III)-chlorid, das durch Dimerisierung auch zu gelöstem (FeCl3)2
reagieren kann. Da jedoch kein Niederschlag, sondern eine Färbung vorliegt,
wurde auf eine quantitative Untersuchung verzichtet, weil eine Eindampfung zu
lange dauern würde, die Ausbeute zu gering wäre und noch Fremdsalze vorhanden
wären.
Der
weiße Niederschlag ist schwerlösliches Bariumsulfat: Das Ba2+-Kation
reagiert mit dem SO42--Anion der Schwefelsäure. Da in dem
Leuchtsatz ein Sauerstoffträger nicht fehlen darf, liegt die Vermutung nahe, daß
hier Bariumnitrat verwendet wird, weil dieser gleich auf doppelte Weise nützlich
ist: Er spendet Sauerstoff und ist für die grüne Farbe des Feuers
mitverantwortlich. Auf diese Weise kann man anhand der gravimetrischen
Bestimmung des Bariumsulfats auf die Menge des Bariumnitrats schließen.
Aufgrund dieser Überlegungen
verläuft die Reaktion also folgendermaßen:
![]()
Die
glasige Substanz, die nach Hinzugabe von NaOH entsteht, ist sehr rätselhaft.
Es ist aber sehr wahrscheinlich ein Hydroxid.
Eisen(II)-hydroxid und Eisen(III)-hydroxid fallen jedoch aufgrund der Färbung
außer Betracht. Die erste Verbindung bildet einen weißen Niederschlag, die
zweite einen rotbraunen Niederschlag. Deshalb ist es schwierig herauszubekommen,
um welche Verbindung es sich handeln könnte. Normalerweise müßte man davon
ausgehen, daß das Eisen(III)-chlorid mit dem Natriumhydroxid zu dem rotbraunen
Eisen(III)-hydroxid reagiert. Es gibt deswegen nur zwei Vermutungen:
· Die gelbe Flüssigkeit besteht nicht aus Eisen(III)-chlorid.
· Es hat sich eine mir unbekannte Komplexverbindung gebildet.
2.3.5.2. Versuch 2:
Ein Nachweis der Substanz durch Flammenfärbung bringt auch keine nennenswerten Erkenntnisse. Die Substanz hat die Flamme nicht gefärbt. Somit fallen also die Alkali- und einige Erdalkalimetalle außer Betracht.
Nach ein paar Tagen fällt zudem auf, daß die Chemikalie sich verflüssigt hat und somit hygroskopisch ist. Die Substanz bleibt also weiterhin unbekannt.
2.3.5.3. Versuch 3:
2.3.5.3.1. Versuchsbeschreibung:
Der hydrophobe Bestandteil aus Versuch 1 wird mit 4 ml 5 M NaOH versetzt. Es tritt ein leichtes Schäumen ein. Anschließend wird zentrifugiert und der Überstand in ein neues Reagenzglas abpipettiert, zu dem ein paar Tropfen 1 M Calciumacetatlösung hinzugegeben werden. Es bildet sich ein weißer Niederschlag.
2.3.5.3.2. Versuchsergebnis:
Der weiße Niederschlag ist sehr wahrscheinlich entstandenes Aluminiumhydroxidacetat. Das elementare Aluminium hat mit dem Natriumhydroxid zu einem löslichen Komplexsalz reagiert.
Mikroskopische Untersuchung des Satzes:
(1) Dazu werden einige Körner des „grauen Satzes“ auf den Objektivträger gegeben. Es wird eine Vergrößerung von 16x5 eingestellt. Man sieht matt weiße Salze in unterschiedlichen Korngrößen, die sich an metallisch glänzende Bröckchen gelagert haben. Außerdem sind klare stäbchenförmige Kristalle zu sehen. Sehr vereinzelt sind merkwürdige rotbraune Kügelchen zu entdecken. Bei einer Vergrößerung von 16x20 kann man einzelne Oberflächen betrachten, was aber keine Vorteile bringt.
Ergebnis:
Eines der klaren Salze wird auf jeden Fall das schon bewiesene Bariumnitrat sein. Andere weiße Salze, vor allem diese vereinzelten rotbraunen Kügelchen, könnten möglicherweise Abbrandreglerstoffe, wie z.B. PVC, sein. Es könnten aber auch Zusatzstoffe zur Flammenfärbung sein, wie z.B. Bariumoxalat. Die im Gegensatz zu den anderen Körnern doppelt so groß wirkenden Metallbrocken werden wohl Aluminiumstückchen sein.
(2) Untersucht man den Teil des dunklen Satzes, erkennt man kohlefaserartige schwarze Brocken, die mit matt weißen Salzkörnern zusammenkleben. Nur vereinzelt erkennt man Metallstückchen.
Ergebnis:
Die schwarzen Brocken sind Kohlestückchen, die als Verbrennungsmittel dienen, und die matt weißen Körner sind der Sauerstofflieferant dafür. Die Aluminiumstücke sind vermutlich aus dem „grauen Teil“ der Fontäne versehentlich mit reingeraten.
2.3.5.4. Versuch 4: Flammenfärbung
2.3.5.4.1. Versuchsbeschreibung:
Eine geringe Probe des Satzes wird auf ein Magnesiastäbchen gegeben, daß zuvor mit konz. Salzsäure gereinigt wurde. Anschließend wird es in die Flamme des Bunsenbrenners gehalten. Sofort erscheint eine helle grüne Stichflamme. Danach wird die Bunsenbrennerflamme für kurze Zeit violettfarbig.
2.3.5.4.2. Versuchsergebnis:
Die grüne Flamme kommt durch das Barium. Anscheinend ist aber auch ein geringer Anteil eines Kaliumsalzes in dem Satz enthalten.
Berechnung des Bariumnitratgehaltes:
Als leeres Reagenzglas wog dies 6,6224 g. Mit dem Bariumsulfat wiegt es nun 6,93812 g. Das bedeutet, das BaSO4 wiegt 0,31572 g. Mit Hilfe von diesen Angaben und der Reaktionsgleichung kann man die Menge des Bariumnitrats errechnen. Der Rechnung nach müßten also ca. 0,35 g Bariumnitrat in den grünen Fontänen enthalten sein.

2.3.6. Zusammenfassung der Versuchsergebnisse:
Der Inhalt eines grünen Geisterlichtes setzt sich aus einer dünnen Schicht schwarzen Pulvers zusammen, unter der sich das Kernstück des Satzes, nämlich das graue Pulver befindet. Unter diesem wiederum ist noch einmal eine dunklere Mischung vorhanden, die sehr wahrscheinlich als Treibladung dient. Die dunkleren Mischungen sind wahrscheinlich Abwandlungen von Schwarzpulversätzen[2]. Der Flammentest beweist die Anwesenheit von Kalium. Vermutlich wird hier Kaliumnitrat verwendet, der auch in geringen Mengen in dem grauen Leuchtsatz zu entdecken ist (siehe Flammenfärbung). Vielleicht hat sich aber auch beim Ausschütten ein wenig von dem dunkleren Satz in den grauen gemogelt.
In dem grauen Leuchtsatz ist auf jeden Fall Bariumnitrat enthalten, das für eine grüne Flamme sorgt. Allerdings bestätigt der Nitrattest nicht unbedingt die Anwesenheit von ca. 57% Bariumnitrat. Der Nitrattest hat einen Wert von etwas mehr als 40% ergeben. Es kann aber auch sein, daß nicht nur Bariumnitrat als Flammenfärber benutzt wird, sondern auch z.B. Bariumoxalat. Dies könnte die erhöht gemessene Bariumsulfatmenge erklären. Es ist aber auch hier nicht gewährleistet, daß das Bariumsulfat ganz wasserfrei gewesen ist und es zu Folgefehlern in der Rechnung kam.
Aluminiumpulver ist auch in der Fontäne enthalten, was die mikroskopische und chemische Analyse bestätigen. Unklar ist jedoch, welche weiteren Stoffe enthalten sind. Ein Eisensalz wäre zumindest als Abbrandregler oder Oxidationsmittel zwar möglich, konnte aber nicht speziell nachgewiesen werden. PVC wird in einigen Leuchtsätzen verwendet und könnte auch hier eine Rolle spielen. Auf diese Substanz und auch auf organische Substanzen konnte jedoch nicht geprüft werden.
2.4. Analyse von „Dicke Brummer“
2.4.1. Allgemeines:
Es werden „Dicke Brummer“ der Firma „Weco“ verwendet, Artikelnummer 4918, die in 3er-Packungen in den Handel kommen. Die BAM-Zulassungsnummer dieses Produktes lautet „BAM-PI-0504“. Ein pyrotechnischer Gegenstand wiegt insgesamt 7,57 g, von denen 1,52 g Effektsatz enthalten sind.
2.4.2. Aufbau:

![]()
2.4.3. Vorbereitungen:
Um die chemischen Stoffe dieses Feuerwerkskörpers zu analysieren, muß das dickwandige Papprohr mit Hilfe einer Laubsäge in der Mitte durchsägt werden.
Nun ist der Effektsatz frei zugänglich. Mit einem Zahnstocher muß allerdings der Satz auseinandergebröckelt werden, da der Satz extrem verdichtet ist.
2.4.4. Nitratnachweis:
Es werden exakt 10 mg vom Satz abgewogen. Anschließend wird der Nitrattest nach Merck durchgeführt. Die Farbskala deutet auf einen Nitratgehalt zwischen 40-60 mg/l. Die Farbe scheint aber nur um eine kleine Nuance dunkler, so daß der Wert wohl ein bißchen über 40 mg/l liegt.
2.4.5. Versuche:
2.4.5.1. Versuch 1:
2.4.5.1.1. Versuchsbeschreibung:
Zu 0,2 g Pulver von „Dicke Brummer“ werden 4 ml Wasser gegeben, vermischt, zentrifugiert und in ein neues Reagenglas abpipettiert.
Zu diesem werden nun 2 ml 1 M Schwefelsäure hinzugegeben. Sofort fällt ein weißer Niederschlag aus, der anschließend zentrifugiert wird. Von den nun 6 ml werden 4 ml in ein neues Reagenzglas abpipettiert. Von den anderen 2 ml wird 1 ml in Reagenzglas Nummer 2 getan und 1 ml in Reagenzglas Nummer 3, mit denen später weiterexperimentiert wird. Nach Hinzugabe von 2 ml 12 M Salzsäure bilden sich leichte, klare Schlieren, aber ansonsten ist keine Reaktion zu erkennen.
Zu den 6 ml kommen nun 8 ml 5 M Natriumhydroxidlösung, damit die Lösung alkalisch wird. Nichts passiert.
Von den 14 ml Reagenzglas Nummer 1 werden 4 ml in ein neues Reagenzglas gefüllt und mit 2 ml 12 M HCl angesäuert. Anschließend werden 2 ml 1 M Calciumacetatlösung hinzugegeben. Es passiert nichts. Nach Hinzugabe von 0,5 ml 1 M Kaliumjodidlösung färbt sich die Flüssigkeit gelb.
2.4.5.1.2. Versuchsergebnis:
![]()
Der weiße Niederschlag
wird wohl zumindest zu einem großen Teil ausgefallenes Bariumsulfat oder
Strontiumsulfat sein. Sind Bariumionen enthalten, fällt auf jeden Fall
Bariumsulfat aus, auch wenn Strontiumionen dabei sind. Es kann allerdings auch
weißes Bleisulfat entstanden sein.
Da
keine Fällungsreaktion mit NaOH stattfindet, können wir davon ausgehen, daß
keine Eisenionen vorhanden sind.
Da
nach Hinzugabe von Calciumacetatlösung kein Niederschlag ausgefallen ist,
werden wohl keine Aluminiumionen vorhanden sein.
Die
Gelbfärbung könnte durch eine geringe Menge Bleiiodid entstanden sein. Da aber
kein Niederschlag ausgefallen ist und sich PbI2 nur zu 0,08% in
Wasser löst [9], ist es wahrscheinlicher, daß sich ein wenig Jod gebildet hat.
Dies wäre ein Indiz für Chlorat.
In
saurem Milieu ist Chlorat ein starkes Oxidationsmittel. So wird aus Kaliumiodidlösung
Jod ausgeschieden:
![]()
Interessant wäre
gewesen, wenn man die Salzsäure nach dem Kaliumiodid hinzugegeben hätte. Wäre
es dann auch gelb gewesen, dann wäre es mit ziemlicher Sicherheit ein Nachweis
von einer winzigen Menge Bleiiodid.
2.4.5.2.Versuch 2:
2.4.5.2.1. Versuchsbeschreibung:
Von Reagenzglas Nummer 1 wird 1 ml Flüssigkeit in ein neues Reagenzglas gegeben und mit 1 ml 1 M Natriumthiocyanat-Lösung versetzt. Keine Reaktion.
2.4.5.2.2. Versuchsergebnis:
Es sind auf keinen Fall Fe3+-Ionen enthalten, obwohl dies schon nach der Hinzugabe von NaOH aus Versuch 1 feststand. Es hätte aber sein können, daß die Eisenionen-Konzentration für den Hydroxid-Test zu gering gewesen ist. Das Reagenz aus Natriumthiocyanat dagegen reagiert schon auf sehr geringe Mengen.
2.4.5.3. Versuch 3:
2.4.5.3.1. Versuchsbeschreibung:
Zu 1 ml von Reagenzglas Nummer 2 werden ein paar Tropfen 1 M Silbernitratlösung hinzugetan. Sofort bildet sich ein weißer Niederschlag.
2.4.5.3.2. Versuchsergebnis:
In dem pyrotechnischen Satz muß ein Chlorid-Salz enthalten sein, da Chloridionen in der Lösung vorhanden sind und mit dem Silberkation zu Silberchlorid reagiert haben.
2.4.5.4. Versuch 4:
2.4.5.4.1. Versuchsbeschreibung:
Zu der weißen Substanz aus Versuch 1 fügt man 4 ml 5 M NaOH hinzu und schüttelt kräftig durch. Die Substanz hat sich anscheinend ein wenig gelöst. Nun wird zentrifugiert, die klare Lösung abpipettiert und in ein neues Reagenzglas getan. Anschließend werden dazu ein paar Tropfen 1 M Kaliumiodidlösung hinzugegeben. Es passiert nichts. Es muß erst noch angesäuert werden. Nach Hinzugabe von 2,5 ml 12 M HCl wird schon nach dem ersten Tropfen eine Gelbfärbung sichtbar.
2.4.5.4.2. Versuchsergebnis:
Dieses Ergebnis ist merkwürdig. Im Prinzip wäre dies ein Nachweis für Chlorat. Die einzige Erklärung dafür ist vielleicht, daß beim Ausfällen von Barium- oder Strontiumsulfat ein paar Chlorationen an deren Oberfläche mitgerissen wurden, die sich dann wieder in NaOH gelöst haben und dann mit dem Iodid reagieren konnten. Es kann natürlich auch eine mir unbekannte Fremd-Ionen Reaktion stattgefunden haben, da das Sulfat ganz am Anfang schon ausgefallen ist und noch andere Ionen mitgerissen wurden.
2.4.5.5. Versuch 5:
2.4.5.5.1. Versuchsbeschreibung:
Zu Reagenzglas Nummer 3 wird 1 ml 1 M Kaliumiodidlösung hinzugegeben. Es passiert nichts. Auch nach Hinzugabe von ein paar Tropfen 1 M Natriumthiocyanatlösung findet keine Färbung statt.
2.4.5.5.2. Versuchsergebnis:
Falls in Versuch 1 anfangs Bleiionen enthalten waren, liegen diese nun vollständig als weißes Bleisulfat vor. Ansonsten wäre hier gelbes Bleiiodid ausgefallen. Das NaSCN beweist das Nichtvorhandensein von Eisen(III)-ionen.
2.4.5.6. Versuch 6:
2.4.5.6.1. Versuchsbeschreibung:
Zu den hydrophoben Bestandteilen aus Versuch 1 werden 4 ml 5 M NaOH hinzugegeben. Es wird leicht milchig trüb und fängt an zu schäumen. Unter Gasbildung steigen Metallteilchen nach oben. Anschließend wird zentrifugiert. Da ein metallischer Glanz noch zu erkennen ist, werden weitere 4 ml NaOH hinzugetan, geschüttelt, einen Tag stehen gelassen und dann zentrifugiert. Die Lösung hat einen leichten gelb-braunen Touch bekommen. Ein weißer Niederschlag ist nicht zu erkennen. Es gibt nur einen Bodensatz. (Reagenzglas Nr. 4). Von der Flüssigkeit aus Reagenzglas Nr. 4 werden nun 3,5 ml abpipettiert und in ein neues Reagenzglas getan. Dazu kommen ein paar Tropfen 1 M Calciumacetatlösung hinzu. Es fällt ein weißer Niederschlag aus. Nach Hinzugabe von einigen Tropfen 1 M Natriumthiocyanat passiert nichts.
2.4.5.6.2. Versuchsergebnis:
Die gelbbraune Färbung kommt vermutlich durch das Rosten von Eisen. Merkwürdig dabei ist, daß dieses nicht durch das Natriumthiocyanat nachgewiesen wird, deshalb wird Versuch 7 durchgeführt.
Das Calciumacetat beweist das Vorhandensein von Al3+.
2.4.5.7. Versuch 7:
2.4.5.7.1. Versuchsbeschreibung:
Die Flüssigkeit von Reagenzglas Nr. 4 wird abpipettiert und entsorgt. Zu dem Bodensatz kommen nun 2 ml Wasser und 1 ml 12 M HCl. Es schäumt heftig. Nach dem Zentrifugieren ist die Flüssigkeit klar und gelbstichig. Der Bodensatz hat sich ein wenig gelöst. Die Flüssigkeit wird abpipettiert in ein neues Reagenzglas. Nach Hinzugabe von Natriumthiocyanat ergibt sich ein blutroter Niederschlag:
![]()
2.4.5.7.2. Versuchsergebnis:
Nach Hinzugabe der Salzsäure hat sich elementare Eisen gelöst. Die rote Farbe des Eisenthiocyanats bestätigt das Vorhandensein von dreiwertigen Eisenkationen.
2.4.6. Zusammenfassung der Versuchsergebnisse:
Der Pulversatz in „Dicke Brummer“ ist sehr komprimiert untergebracht. Unter einem Mikroskop kann man keine klaren Strukturen erkennen, weil die Chemikalien förmlich „zusammengebacken“ sind. Auf jeden Fall wird aber Bariumnitrat enthalten sein. Strontiumnitrat ist auch sehr wahrscheinlich enthalten. Der Nitratgehalt liegt hier bei ca. 40%. Das ist meiner Meinung nach zu wenig als Sauersauerstofflieferant. Deshalb halte ich es für möglich, daß Chlorate enthalten sind, was Versuch 4 beweisen würde. Dagegen spricht jedoch die Gefährlichkeit. Es könnten allerdings auch noch andere Oxide als Sauerstofflieferant dienen, was jedoch nicht bewiesen wurde. Als Verbrennungsstoff wird auch hier Aluminium verwendet, damit man auf die hohen Temperaturen kommt, die für Leuchteffekte nötig sind. Magnesium hätte zwar auch drin sein können, konnte aber nicht nachgewiesen werden, da keine weiße Substanz nach Hinzugabe von Natriumhydroxid entstanden ist. Es hätte auch gefährlich sein können, wenn Chlorat enthalten wäre. Eisenpulver ist zu einem großen Anteil enthalten. Ein Chlorid scheint auch enthalten zu sein, vermutlich Strontium- und/oder Bariumchlorid, weil sie zusätzlich für Brillianz an Farbe sorgen. Es könnte aber auch Natriumchlorid sein, was für eine gelbe Flamme verantwortlich ist.
2.5. Analyse von „Tolle Biene“
2.5.1. Allgemeines:
Es wird „Tolle Biene“ der Firma „Moog“ verwendet, Artikelnummer 4402, die in 5er-Packungen in den Handel kommen. Die BAM-Zulassungsnummer lautet „BAM-PI-0516“. Ein Feuerwerkskörper wiegt 3,96 g, von denen 0,9 g als Effektsatz dienen.
2.5.2. Aufbau:

![]()
2.5.3. Vorbereitungen:
Bei diesem Feuerwerkskörper muß das Papprohr durchsägt werden, um an den Feuerwerkssatz zu gelangen, der aus dunklem Pulver besteht.
2.5.4. Nitratnachweis:
Man versucht, ca. 10 mg abzuwiegen. Die Waage zeigt einen Wert von 0,01044 g an. Anschließend wird der Nitrattest nach Vorschrift angewendet. Die Farbskala zeigt einen Wert zwischen 40 und 60 mg/l an.
2.5.5. Versuche:
2.5.5.1. Versuch 1:
2.5.5.1.1. Versuchsbeschreibung:
Zu 0,2 g Pulver werden 4 ml Wasser hinzugefügt. Danach
wird alles geschüttelt und anschließend zentrifugiert. Nach dem Zentrifugieren
hat sich keine klare Trennung ergeben. Schwarzer Staub drängt langsam nach
oben. Es wird ein weiteres Mal zentrifugiert und sofort die Flüssigkeit in ein
anderes Reagenzglas abpipettiert. Zu diesem werden dann 1 ml 12 M Salzsäure
hinzugegeben. Es passiert nichts. Nun werden 2 ml 1 M Schwefelsäure hinzugefügt.
Es entsteht ein weißer Niederschlag. Es wird zentrifugiert und von den 7 ml 4
ml in ein neues Reagenzglas abpipettiert. Die restlichen 3 ml werden in Reagenzglas
1 abpipettiert. Anschließend werden hierzu 10 ml 5 M NaOH hinzugegeben. Es
findet keine Reaktion statt.
Von
den 14 ml in Reagenzglas 2 werden 4
ml in ein neues Reagenzglas gegeben und mit 2 ml 12 HCl angesäuert. Anschließend
wird 1 ml 1 M Calciumacetatlösung hinzugegeben. Es erfolgt keine Reaktion. Nach
Hinzugabe von 0,5 ml 1 M Kaliumiodidlösung färbt sich die Flüssigkeit ganz
schwach gelblich.
2.5.5.1.2. Versuchsergebnis:
Vermutlich liegen keine Eisensalze vor, ansonsten hätte
spätestens beim Zufügen von NaOH ein Niederschlag ausfallen müssen. Jedoch
hat sich ein weißer Niederschlag aus Barium- oder Strontiumsulfat gebildet, der
beweist, daß Barium- bzw. Strontiumionen enthalten sind. Al3+-Ionen
sind ebenfalls nicht enthalten.
Die schwache Gelbfärbung durch eine winzige Menge Iod
ist ein Indikator für das Vorhandensein von Chlorat. Das Chlorat ist demnach
bis zum letzten Schritt in Lösung geblieben.
2.5.5.2. Versuch 2:
2.5.5.2.1. Versuchsbeschreibung:
Von Reagenzglas 2 werden 2 ml in ein neues Reagenzglas gegeben und mit 1 ml 1 M Natriumthiocyanatlösung versetzt. Es entsteht keine Färbung.
2.5.5.2.2. Versuchsergebnis:
Aufgrund der sehr starken Verdünnung in Reagenzglas 2 kann auch das auf sehr geringe Eisen-Konzentrationen reagierende Thiocyanat keine Fe3+-Ionen feststellen.
2.5.5.3. Versuch 3:
2.5.5.3.1. Versuchsbeschreibung:
Zu der weißen Substanz aus Versuch 1 fügt man 4 ml 5 M NaOH hinzu. Anschließend wird geschüttelt und das Reagenzglas in die Zentrifuge gestellt. Der Überstand wird in ein neues Reagenzglas pipettiert, zu dem ein paar Tropfen 1 M Kaliumiodidlösung hinzugegeben werden. Auch nach Hinzugabe von 2 ml 12 M HCl passiert nichts.
2.5.5.3.2. Versuchsergebnis:
Durch die weiße Substanz wurden keine Chlorat-Ionen mitgerissen. Man kann außerdem davon ausgehen, daß kein weißes Bleisulfat durch Zugabe von Schwefelsäure aus Versuch 1 ausgefallen ist (das sowieso schon durch Beigabe von Salzsäure ausgefallen wäre, wenn es vorhanden gewesen wäre), weil es sich ansonsten in Natriumhydroxid gelöst und anschließend durch das KI zu Bleiiodid reagiert hätte.
2.5.5.4. Versuch 4:
2.5.5.4.1. Versuchsbeschreibung:
Zu Reagenzglas 1 wird 1 ml Kaliumiodidlösung hinzugegeben. Die Flüssigkeit färbt sich gelb. Anschließend werden ein paar Tropfen 1 M Natriumthiocyanatlösung hinzugegeben. Es erfolgt keine Reaktion.
2.5.5.4.2. Versuchsergebnis:
Da die Lösung durch Salz- und Schwefelsäure aus Versuch 1 angesäuert wurde, funktioniert der Chlorattest mit KI. Da in Versuch 1 der Nachweis schon erbracht wurde, nachdem die Lösung sehr verdünnt war, ist es wohl nicht sehr verwunderlich, daß hier der Chlorattest noch besser funktioniert.
2.5.5.5. Versuch 5:
2.5.5.5.1. Versuchsbeschreibung:
Zu dem Festsatz aus Versuch 1 werden 6 ml 5 M NaOH gegeben. Der Festsatz fängt an zu schäumen. Dann, nach anschließender Zentrifugierung, werden 3 ml in ein neues Reagenzglas pipettiert und ein paar Tropfen Acetatlösung hinzugegeben. Dadurch bildet sich ein weißer Niederschlag, der erst einmal zentrifugiert wird. Nun wird der Überstand in ein neues Reagenzglas gegeben und mit Thiocyanat versetzt. Es findet jedoch keine Reaktion statt.
2.5.5.5.2. Versuchsergebnis:
Anscheinend hat sich Aluminium gelöst und mit dem Acetat zu einem weißen Niederschlag weiter reagiert. Magnesium wäre zwar auch möglich, allerdings löst sich dieses nicht in NaOH.
Das Vorhandensein von Eisen(III)-ionen ist durch das Nichtreagieren von Thiocyanat ausgeschlossen.
2.5.6. Zusammenfassung der Versuchsergebnisse:
„Tolle Biene“ besteht zu etwa 50% aus Nitrat. Da es nach dem Anzünden grün, rot und gelb leuchtet, ist Bariumnitrat und Strontiumnitrat sowie ein Natrium-Salz in dem Leuchtsatz vorhanden. Vermutlich reicht jedoch die Hälfte der Mischung nicht für eine genügende Sauerstoffversorgung aus, weshalb auf Chlorat zurückgegriffen wird. Nicht untersuchte organische Komponenten sind aber genauso möglich wie polymere Bestandteile, die leicht Halogene abgeben. Mit Sicherheit ist jedoch Aluminium als Brennelement enthalten. Eisensalze konnten nicht nachgewiesen werden.
2.6. Analyse von „Feuerwirbel“
2.6.1. Allgemeines:
Es werden „Feuerwirbel“ der Firma „Weco“ verwendet, Artikelnummer 4404, die in 10er Packungen in den Handel kommen. Die BAM-Zulassungsnummer dieses Produktes lautet „BAM-PI-0548“. Das Gewicht eines „Feuerwirbels“ beträgt 0,53 g, von denen 0,22 g den Effektsatz ausmachen.
2.6.2. Aufbau:

![]()
2.6.3. Vorbereitungen:
Um den Effektsatz zu untersuchen, wird der Ring zunächst mit Gewalt von seiner Ringform befreit. Anschließend wird die Plastikfolie, die um den Gegenstand gewickelt ist, entfernt. Nun kann man die Papierummantelung entfernen und gelangt zu dem dunklen Pulversatz.
2.6.4. Nitratnachweis:
Man versucht ca. 10 mg des Pulvers abzuwiegen. Die Waage zeigt ein Gewicht von 0,01045 g an. Der Nitrattest nach Anleitung zeigt einen Wert zwischen 60 und 80 mg/l an, wobei die Farbe eher einen Wert annimmt, die den 80 mg/l entsprechen.
2.6.5. Versuche:
2.6.5.1. Versuch 1:
2.6.5.1.1. Versuchsbeschreibung:
Zu den 0,22 g Pulver werden 4 ml
Wasser gegeben, durchmischt, zentrifugiert, und anschließend die Flüssigkeit
vorsichtig in ein neues Reagenzglas abpipettiert. Zu diesem wird 1 ml 12 M HCl
hinzugegeben. Es passiert nichts. Nun wird 1 ml 1 M Schwefelsäure hinzugegeben.
Es passiert wieder nichts. Es wird zu den 6 ml 8 ml 5 M NaOH gegeben. Auch hier
passiert nichts.
Von den 14 ml Reagenzglas
1 werden 4 ml in ein neues Reagenzglas getan und mit 2 ml 12 M HCl angesäuert.
Anschließend werden 2 ml 1 M Calciumacetatlösung hinzugegeben. Es passiert
nichts. Nach Hinzugabe von 0,5 ml 1 M KI-Lösung färbt sich die Lösung sehr
schwach gelblich.
2.6.5.1.2. Versuchsergebnis:
Diese Proben beweisen lediglich das Vorhandensein von einer minimalen Menge Chlorat, da sich Iod gebildet hat. Barium- und Strontiumsalze sind in dieser Mischung auf jeden Fall nicht enthalten. Auch ein Aluminiumsalz ist ausgeschlossen. Dreiwertige Eisensalze konnten ebenfalls nicht nachgewiesen werden, weil sich ansonsten rotbraunes Eisen(III)-hydroxid gebildet hätte.
2.6.5.2. Versuch 2:
2.6.5.2.1. Versuchsbeschreibung:
Von Reagenzglas 1 wird 1 ml Flüssigkeit in ein neues Reagenzglas getan, zudem 1 ml 1 M Natriumthiocyanatlösung hinzugefügt wird. Keine Färbung.
2.6.5.2.2. Versuchsergebnis:
Dieses Reagenz hat das Vorhandensein von Fe3+-Ionen endgültig ausgeschlossen.
2.6.5.3. Versuch 3:
2.6.5.3.1. Versuchsbeschreibung:
Zu den wasserunlöslichen Bestandteilen aus Versuch 1 werden 6 ml 5 M NaOH hinzugegeben. Es entsteht sehr wenig Gasentwicklung. Anschließend wird zentrifugiert und 3 ml in ein neues Reagenzglas abpipettiert. Nach Hinzugabe von ein paar Tropfen 1 M Calciumacetatlösung bildet sich ein leichter milchiger Niederschlag. Das Zentrifugat wird nun noch mit ein paar Tropfen Natriumthiocyanat behandelt. Es findet keine Reaktion statt.
2.6.5.3.2. Versuchsergebnis:
Elementares Aluminium hat sich in NaOH gelöst und hat mit dem Calciumacetat ein Aluminiumhydroxidacetat gebildet. Es muß sich aber um eine geringe Menge handeln.
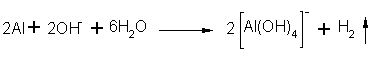
![]()
Fe3+-Ionen scheinen nicht enthalten zu sein.
2.6.5.4. Versuch 4:
2.6.5.4.1. Versuchsbeschreibung:
Eine winzige Menge des dunklen Pulvers wird in den Bunsenbrenner gehalten. Nach einer kleinen Stichflamme, färbt sich die Bunsenbrennerflamme violett. Die Luft riecht ein wenig nach Schwefeldioxid.
2.6.5.4.2. Versuchsergebnis:
Kalium und Schwefel sind mit sehr hoher Wahrscheinlichkeit in dem Brennsatz enthalten.
2.6.6. Zusammenfassung der Versuchsergebnisse:
Außer einer kaum meßbaren Menge Chlorat, und wahrscheinlich ist dies Kaliumchlorat, ist außerdem eine geringe Menge Aluminium enthalten. Der dunkle Satz verrät das Vorhandensein von Holzkohle. Vermutlich besteht dieser Satz aus einem sehr großen Anteil Kaliumnitrat. Vermutlich sind dies ca. 80%, wenn es nach dem Nitrattest geht. Ein geringer Anteil Schwefel ist auch enthalten. Abgesehen von dem Chlorat und dem Aluminium stellt diese Art von pyrotechnischem Satz eine Schwarzpulvervariante dar.
2.7. Analyse von „Flitze Feuerstein“
2.7.1. Allgemeines:
Es wird „Flitze Feuerstein“, ein Mini-Vulkan der Firma „Weco“ untersucht, der in 5er-Packungen in den Laden kommt. Die Artikelnummer ist 4220 und die Zulassungsnummer der Bundesanstalt für Materialprüfung für diesen Artikel lautet „BAM-PI-0586“. Das Gewicht eines Vulkans beträgt 8,36 g, von denen 3,06 g Effektsatz enthalten sind. Somit liegt dieser Mini-Vulkan an der äußersten Grenze für Feuerwerksartikel der Klasse I.
2.7.2. Aufbau:

![]()
2.7.3. Vorbereitungen:
Um an das zu untersuchende Pulver zu gelangen, wird die Zündschnur durch kräftiges Ziehen entfernt. Das violettfarbene Seidenpapier wird anschließend ebenfalls entfernt. Nun kann man das Pulver bequem ausschütten. Es fällt auf, daß es sich um einen extrem schwarzen Pulversatz handelt, in dem einzelne Kügelchen zu finden sind.
2.7.4. Nitratnachweis:
Man versucht, ca. 10 mg des Mini-Vulkans abzuwiegen. Die Waage zeigt 0,01086 g an. Danach wird der Nitrattest nach Anleitung durchgeführt, der nach der Farbskala einen Wert zwischen 60 und 80 mg/l ergibt.
2.7.5. Versuche:
2.7.5.1. Versuch 1:
2.7.5.1.1. Versuchsbeschreibung:
Zu 0,2 g Pulver werden 4 ml Wasser gegeben und anschließend
zentrifugiert. Danach werden die 4 ml in ein neues Reagenzglas abpipettiert, zu
dem 2 ml 12 M HCl hinzugefügt werden. Es erfolgt keine Reaktion. Nach Hinzugabe
von 3 ml 1 M Schwefelsäure stellt sich eine geringe Trübung ein und nach einer
Zentrifugation setzt sich eine winzige weiße Menge am Boden ab. Von den 9 ml
werden 4 ml in ein neues Reagenzglas getan, zu dem 10 ml 5 M NaOH hinzugefügt
werden, damit die Lösung alkalisch wird. Es passiert nichts.
Von
den 14 ml aus Reagenzglas 1 werden 4
ml in ein neues Reagenzglas gegeben und mit 2 ml 12 M HCl angesäuert. Anschließend
werden 0,5 ml 1 M Calciumacetat hinzugefügt. Es passiert nichts. Auch nach
Hinzugabe von 0,5 ml 1 M Kaliumiodidlösung erfolgt keine Reaktion.
2.7.5.1.2. Versuchsergebnis:
Die weiße Menge ist Barium- oder Strontiumsulfat. Eisen- und Aluminiumsalze sind nicht in der Mischung. Chlorat konnte ebenfalls nicht nachgewiesen werden.
2.7.5.2. Versuch 2:
2.7.5.2.1. Versuchsbeschreibung:
Von Reagenzglas 1 wird 1 ml Flüssigkeit in ein neues Reagenzglas gegeben und mit 1 ml 1 M Natriumthiocyanatlösung versetzt. Es tritt keine Färbung auf.
2.7.5.2.2. Versuchsergebnis:
Es sind keine Fe3+-Ionen vorhanden.
2.7.5.3. Versuch 3:
2.7.5.3.1. Versuchsbeschreibung:
Der Überstand der weißen Substanz aus Versuch 1 wird abpipettiert und in Reagenzglas 3 gegeben. Anschließend werden 4 ml 5 M NaOH zu der weißen Substanz hinzugegeben, geschüttelt und zentrifugiert. Die klare Flüssigkeit wird vorsichtig abpipettiert und in ein neues Reagenzglas getan, zu dem ein paar Tropfen 1 M Kaliumiodidlösung hinzugegeben werden. Auch nach anschließender Ansäuerung mit 4 ml 12 M HCl erfolgt keine Reaktion.
2.7.5.3.2. Versuchsergebnis:
Es wurde kein Chlorat gefunden. Das Chlorat wurde also nicht durch die Fällungsreaktion mit der Schwefelsäure mitgerissen.
2.7.5.4. Versuch 4:
2.7.5.4.1. Versuchsbeschreibung:
Zu Reagenzglas 3 wird 0,5 ml 1 M Kaliumiodidlösung hinzugetan. Die Lösung färbt sich gelb. Nach Hinzugabe von Natriumthiocyanatlösung findet keine Reaktion statt.
2.7.5.4.2. Versuchsergebnis:
Es ist also doch noch Chlorat enthalten, jedoch enthält die Lösung keine Eisen(III)-ionen.
2.7.5.5. Versuch 5:
2.7.5.5.1. Versuchsbeschreibung:
Zu dem wasserunlöslichen Teil aus Versuch 1 am Anfang des Versuches werden 6 ml 5 M NaOH hinzugegeben. Die Lösung fängt an, leicht zu schäumen. Nach ein paar Tagen ist die Flüssigkeit rötlich gefärbt, und am Boden befindet sich eine geringe Menge weißen Pulvers. Nun wird zentrifugiert und pipettiert ca. 3 ml des Überstandes in ein neues Reagenzglas, in das einige Tropfen Calciumacetat hinzugegeben werden. Ein weißer Niederschlag fällt aus. Eine Hinzugabe von ein paar Tropfen Natriumthiocyanat ergibt eine intensive Rotfärbung der Flüssigkeit.
2.7.5.5.2. Versuchsergebnis:
Die rötliche Färbung kommt durch Eisen(III)-hydroxid, das sich nach einigen Tagen gebildet hat, zustande. Den Beweis dafür bringt das Thiocyanat, das einen roten Niederschlag bewirkt. Es befindet sich also elementares Eisen in dem Festsatz. Das weiße Pulver, welches im unteren Reagenzglas niedergeschlagen ist, deutet auf eine geringe Menge von Magnesiumhydroxid. Der weiße Niederschlag nach Hinzugabe des Acetates beweist die Existenz von Aluminium, das sich im Hydroxid zu einem Komplex gelöst hat und als Aluminiumhydroxidacetat ausgefallen ist.
2.7.5.6. Versuch 6:
2.7.5.6.1. Versuchsbeschreibung:
Es werden die einzelnen Kügelchen, von denen in der Vorbereitung geredet wurde, in die Flamme des Bunsenbrenners gehalten. Anschließend wird nur das schwarze Pulver verbrannt.
2.7.5.6.2. Versuchsergebnis:
Jedes Kügelchen reagiert anders: Das eine leuchtet grün
auf, das andere rot, ein anderes wiederum leuchtet grell weiß.
Das schwarze Pulver bewirkt in der farblosen Flamme des
Bunsenbrenners, nachdem es Funken gesprüht hat, eine violettfarbene Flamme. Es
ist also Kalium enthalten.
2.7.6. Zusammenfassung der Versuchsergebnisse:
Im Verhältnis zu den anderen Feuerwerkskörpern ist im Minivulkan „Flitze-Feuerstein“ die größte Menge an Kohle drin. Der Nitratgehalt liegt ungefähr bei 70%. Das bedeutet, daß Barium- und Strontiumnitrat nicht die Hauptlieferanten für Sauerstoff sind. In Versuch 1 ist nur eine sehr winzigen Menge nachgewiesen wurden. Möglicherweise resultiert dies durch ein paar Kügelchen, die in der Probe mituntersucht worden. Den Hauptanteil wird wohl Kaliumnitrat ausmachen und ein wenig das Chlorat. Sie dienen zusammen mit dem Kohlenstoff höchstwahrscheinlich als Treibladung. Aluminium und Magnesium sind auch darin enthalten. Magnesium ist wahrscheinlich in einigen Kügelchen enthalten, die herausgeschleudert werden. Ferner wird auch Eisenpulver in dem Leuchtsatz verwendet, welches für den Funkenflug zuständig ist. Weitere Zutaten konnten leider nicht ermittelt werden.
[1] Bundesanstalt für Materialprüfung und -forschung
[2] Sie bestehen aus Kaliumnitrat, Holzkohle und Schwefel
Weiter zu:
Inhaltsverzeichnis
Einleitung
Analysen
Wirkung
Gefahren
Literaturverzeichnis
Danksagung